|
|
El agua
El agua: La vida se apoya
en su comportamiento anormal
Contenido Revisado

El agua, una molécula simple y extraña, puede ser considerada como el líquido de la vida. Es la sustancia más abundante en la biosfera, dónde la encontramos en sus tres estados
y es además el componente mayoritario de los seres vivos, pues entre el 65 y el 95% del peso de
de la mayor parte de las formas vivas es agua.
El agua fue además el soporte donde surgió la vida. Molécula con un extraño comportamiento que la convierten en una sustancia diferente a la mayoría de los líquidos, posee una manifiesta reaccinabilidad y posee unas extraordinarias propiedades físicas y químicas que van a ser responsables de su
importancia biológica.
Durante la evolución de la vida, los organismos se han adaptado al ambiente acuoso y han desarrollado sistemas que les permiten
aprovechar las inusitadas propiedades del agua.
La molécula de agua está formada por dos átomos de H unidos a un átomo de O por medio de dos enlaces covalentes.
La disposición tetraédrica de los orbitales sp3 del oxígeno determina un ángulo entre los enlaces
H-O-H aproximadamente de 104'5:, además el oxígeno es más electronegativo que el
hidrógeno y atrae con más fuerza a los electrones de cada enlace.
El resultado es que la molécula de agua aunque tiene una carga total neutra (igual número de protones que de electrones ),
presenta una distribución asimétrica de sus electrones, lo que la convierte en una molécula polar, alrededor del oxígeno se concentra una densidad de carga negativa , mientras que los núcleos de hidrógeno quedan desnudos, desprovistos parcialmente de sus
electrones y manifiestan, por tanto, una densidad de carga positiva.
Por eso en la práctica la molécula de agua se comporta como un dipolo
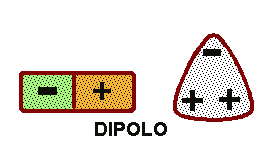
Fig.4 |
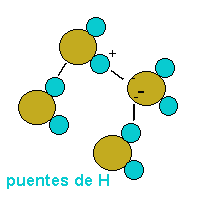
Fig.5 |
Así se establecen interacciones dipolo-dipolo entre las propias moléculas de agua, formándose enlaces o puentes de hidrógeno, la carga parcial negativa del oxígeno de una molécula ejerce atracción electrostática sobre las
cargas parciales positivas de los átomos de hidrógeno de otras moléculas adyacentes.
 Aunque son uniones débiles, el hecho de que alrededor de cada molécula de agua se dispongan otras cuatro molécula unidas por puentes de hidrógeno
permite que se forme en el agua (líquida o sólida) una estructura de tipo reticular, responsable en gran parte de su comportamiento anómalo y de la peculiaridad
de sus propiedades físicoquímicas.
Aunque son uniones débiles, el hecho de que alrededor de cada molécula de agua se dispongan otras cuatro molécula unidas por puentes de hidrógeno
permite que se forme en el agua (líquida o sólida) una estructura de tipo reticular, responsable en gran parte de su comportamiento anómalo y de la peculiaridad
de sus propiedades físicoquímicas.
Principio de página
1. Acción disolvente
- El agua es el líquido que más sustancias disuelve, por eso decimos que es el disolvente universal. Esta propiedad, tal vez la más importante para la vida, se debe a su capacidad para formar puentes de hidrógeno
con otras sustancias que pueden presentar grupos polares o con carga iónica ( alcoholes, azúcares con grupos R-OH , aminoácidos y proteínas con grupos que presentan cargas + y - , lo que da lugar a disoluciones moleculares Fig.7. También las moléculas de agua
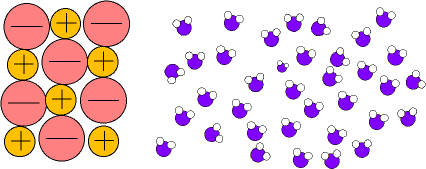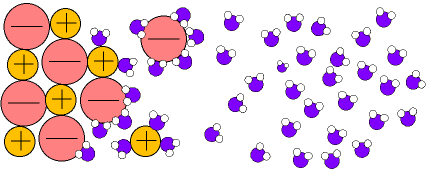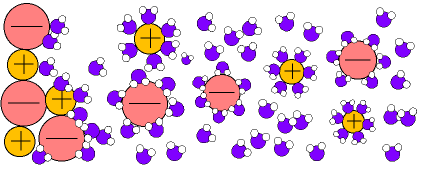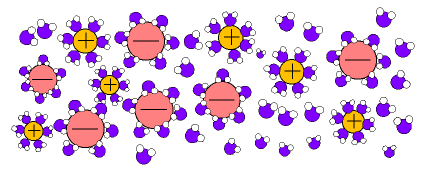
pueden disolver a sustancias salinas que se disocian formando disoluciones iónicas.(Fig.6)
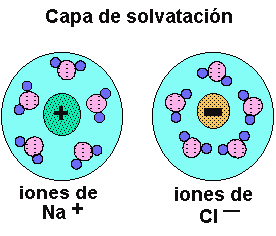
Fig.6 |
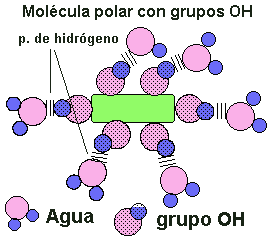
Fig.7 |
En el caso de las disoluciones iónicas (fig.6) los iones de las sales son atraídos por los dipolos del agua, quedando "atrapados" y recubiertos de moléculas de agua en forma de iones hidratados o solvatados.
La capacidad disolvente es la responsable de dos funciones :
- Medio donde ocurren las reacciones del metabolismo
-
Sistemas de transporte
Este efecto puede verse en esta
animacisn, donde vemos a las moliculas de agua separando los iones, e
impidiendo que istos vuelvan a unirse.
2. Elevada fuerza de cohesión
- Los puentes de hidrógeno mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incomprensible.
Al no poder comprimirse puede funcionar en algunos animales como un esqueleto hidrostático, como ocurre en algunos gusanos perforadores capaces de agujerear la roca mediante la presión generada por sus líquidos internos.
3. Elevada fuerza de adhesión
-
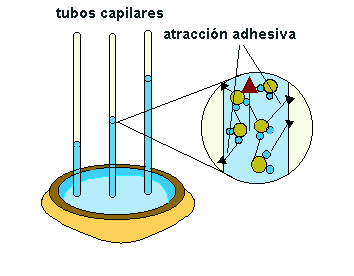
Fig.8 |
Esta fuerza está también en relación con los puentes de hidrógeno que se establecen entre las moléculas de agua y otras moléculas polares y es responsable, junto con la cohesión del llamado fenómeno de la capilaridad.
Cuando se introduce un capilar (Fig.8) en un recipiente con agua, ésta asciende por el capilar como si trepase agarrándose por las paredes, hasta alcanzar un nivel superior al del recipiente, |
donde la presión que ejerce la columna de agua , se equilibra con la presión capilar. A este fenómeno se debe en parte la ascensión de la savia bruta desde las raíces hasta las hojas, a través de los vasos leñosos.
3. Gran calor específico
- También esta propiedad está en relación con los puentes de hidrógeno que se forman entre las moléculas de agua. El agua puede absorber grandes cantidades de "calor" que utiliza para romper los p.de h. por lo que la temperatura se eleva muy lentamente. Esto permite que el citoplasma
acuoso sirva de protección ante los cambios de temperatura. Así se mantiene la temperatura constante .
4. Elevado calor de vaporización
- Sirve el mismo razonamiento, también los p.de h. son los responsables de esta propiedad. Para evaporar el agua , primero hay que romper los puentes
y posteriormente dotar a las moléculas de agua de la suficiente energía cinética para pasar de la fase líquida a la gaseosa.
Para evaporar un gramo de agua se precisan 540 calorías, a una temperatura de 20: C.
Inicio de página
Las funciones del agua se relacionan íntimamente con las propiedades anteriormente descritas.
Se podrían resumir en los siguientes puntos
- Soporte o medio donde ocurren las reacciones metabólicas
- Amortiguador térmico
- Transporte de sustancias
- Lubricante, amortiguadora del roce entre órganos
- Favorece la circulación y turgencia
- Da flexibilidad y elasticidad a los tejidos
- Puede intervenir como reactivo en reacciones del metabolismo, aportando hidrogeniones o hidroxilos al medio.
Inicio
Disociación del agua
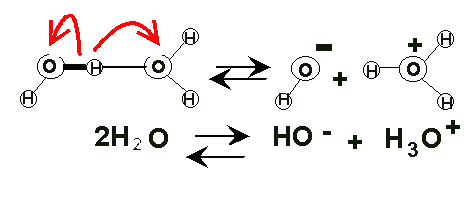
Fig.9 |
El agua pura tiene la capacidad de disociarse en iones, por lo que en realidad se puede considerar una mezcla de :
- agua molecular (H2O )
- protones hidratados (H3O+ ) e
-
iones hidroxilo (OH-)
En realidad esta disociación es muy débil en el agua pura, y así el producto iónico del agua a 25: es
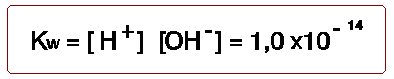
Este producto iónico es constante. Como en el agua pura la concentración de hidrogeniones y de hidroxilos es la misma, significa que la concentración de hidrogeniones es de 1 x 10 -7. Para simplificar los cálculos
Sorensen ideó expresar dichas concentraciones utilizando logaritmos, y así definió el pH como el logaritmo cambiado de signo de la concentración de hidrogeniones. Según ésto:
- disolución neutra pH = 7
- disolución ácida pH < 7
- disolución básica pH > 7
En la figura 10 se señala el pH de algunas soluciones. En general hay que decir que la vida se desarrolla a valores de pH próximos a la neutralidad.
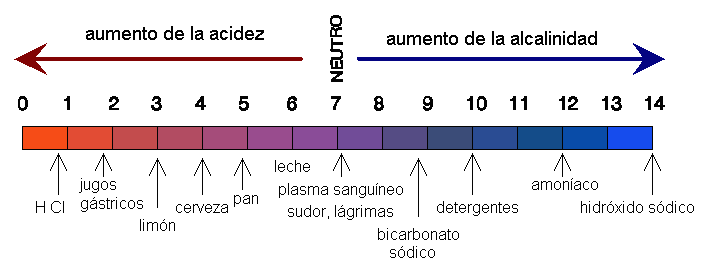
Figura 10 |
Los organismos vivos no soportan variaciones del pH mayores de unas décimas de unidad y por eso han desarrollado a lo largo
de la evolución sistemas de tampón o buffer, que mantienen el pH constante mediante mecanismos homeostáticos.
Los sistemas tampón consisten en un par ácido-base conjugada que actúan como dador y aceptor de protones respectivamente.
El tampón bicarbonato es común en los líquidos intercelulares, mantiene el pH en valores próximos a 7,4, gracias al equilibrio entre el ión bicarbonato y el ácido carbónico, que a su vez se disocia en dióxido de carbono y agua:

Si aumenta la concentración de hidrogeniones en el medio por cualquier proceso químico, el equilibrio se desplaza a la derecha
y se elimina al exterior el exceso de CO2 producido. Si por el contrario disminuye la concentración de hidrogeniones
del medio, el equilibrio se desplaza a la izquierda, para lo cual se toma CO2 del medio exterior.
Top
1. Ósmosis y presión osmótica
- Si tenemos dos disoluciones acuosas de distinta concentración separadas por una membrana semipermeable (deja pasar el disolvente pero no el soluto ), se pruduce el fenómeno de la
ósmosis que sería un tipo de difusión pasiva caracterizada por el paso del agua ( disolvente ) a través de la membrana semipermeable desde la solución más diluida ( hipotónica ) a la más concentrada (hipertónica ), este trasiego continuará hasta que las dos soluciones
tengan la misma concentración ( isotónicas o isoosmóticas ).
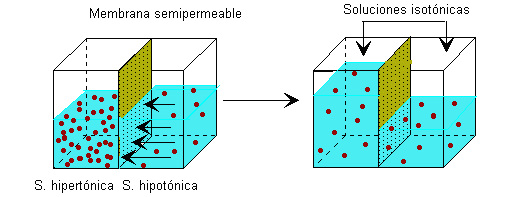
Figura 11 |
Y se entiende por presión osmótica la presión que sería necesaria para detener el flujo de agua a través de la membrana semipermeable.
La membrana plasmática de la célula puede considerarse como semipermeable, y por ello las células deben permanecer en equilibrio osmótico con los líquidos que las bañan.
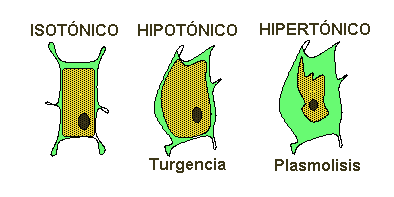
Figura 12 |
Cuando las concentraciones de los fluidos extracelulares e intracelulares es igual , ambas disoluciones son isotónicas.
Si los líquidos extracelulares aumentan su concentración de solutos se hacer hipertónicos respecto a la célula, y ésta pierde agua, se deshidrata y mueren (plamólisis).
Y si por el contrario los medios extracelulares se diluyen, se hacen hipotónicos respecto a la célula, el agua tiende a entrar y las células se hinchan, se vuelven turgentes ( turgescencia ), llegando incluso a estallar. (Figura 12).
2. La difusión y la diálisis
- Los líquidos presentes en los organismos son dispersiones de diversas sustancias en el seno del agua. Según el tamaño de las partículas se formarán dispersiones moleculares o disoluciones verdaderas
como ocurre con las que se forman con las sales minerales o por sustancias orgánicas de moléculas pequeñas, como los azúcares o aminoácidos.

Figura 13 |
Las partículas dispersas pueden provocar además del movimiento de ósmosis , estos otros dos:
La diálisis. En este caso pueden atravesar la membrana además del disolvente, moléculas de bajo peso molecular
y éstas pasan atravesando la membrana desde la solución más concentrada a la más diluida. (Figura 13). Es el fundamento de la hemodiálisis
que intenta sustituir la filtración renal deteriorada.
La difusiónsería el fenómeno por el cual las moléculas disueltas tienden a distribuirse uniformemente en el seno del agua. Puede ocurrir también a través de una membrana si es lo suficientemente
permeable. |
Así se realizan los intercambios de gases y de algunos nutrientes entre la célula y el medio en el que vive.
Principio de página
Además del agua existe otras biomoléculas inorgánicas como las sales minerales.
En función de su solubilidad en agua se distinguen dos tipos: insolubles y solubles en agua.
-
- Sales insolubles en agua.
- Forman estructuras sólidas, que suelen tener función de sostén o protectora, como :
- Esqueleto interno de vertebrados, en el que encontramos : fosfatos, cloruros, y carbonatos de calcio
- Caparazones de carbonato cálcico de crustáceos y moluscos.
- Endurecimiento de células vegetales, como en gramíneas (impregnación con sílice).
- Otolitos del oído interno,formados por cristales de carbonato cálcico (equilibrio).
-
- Sales solubles en agua.
- Se encuentran disociadas en sus iones (cationes y aniones ) que son los responsables de su actividad biológica. Desempeñan las siguientes funciones:
- Funciones catalíticas. Algunos iones, como el Cu+, Mn2+, Mg2+, Zn+,...actúan como
cofactores enzimáticos
- Funciones osmóticas. Intervienen en los procesos relacionados con la distribucisn de agua entre el interior celular y el medio donde vive esa cilula. Los iones de Na, K, Cl y Ca, participan en la
generacisn de gradientes electroqummicos, imprescindibles en el mantenimiento del potencial de membrana y del potencial de accisn y en la sinapsis neuronal.
- Función tamponadora. Se lleva a cabo por los sistemas carbonato-bicarbonato, y tambiin por el monofosfato-bifosfato.
Principio de página
|
|